朱焕章团队报告趋化因子受体修饰CART可提高其体内抗肿瘤活性
发布时间:2021-03-20 00:00:00浏览次数:24747次来源:
目前,嵌合抗原受体 (chimeric antigen receptor, CAR) T细胞治疗血液肿瘤的临床试验已取得了令人鼓舞的疗效,但在实体瘤领域,CAR T细胞治疗效果并不理想,其原因与缺乏肿瘤特异性抗原、T细胞的存活及扩增不足、T细胞向肿瘤组织的迁移效率低和免疫抑制的肿瘤微环境等因素有关。为此,研究者首先将CCR2b/CCR4与靶向间皮素的Msln-CAR融合构建成Msln-CCR2b/CCR4-CAR共表达载体,通过慢病毒感染人原代CD3 T细胞,制备Msln-CCR2b/CCR4-CAR T细胞,使CAR及CCR2b/CCR4均能高效表达。
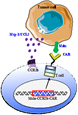
图1. 趋化因子受体CCR2b/CCR4增强Msln-CAR T细胞抗肿瘤模式图
通过transwell实验证明CCR2b及CCR4在体外可以促进CAR T细胞的迁移。将修饰后的肺癌细胞系与CAR T细胞共孵育,体外检测到高效的细胞杀伤及细胞因子分泌。
进一步构建了移植 A549-MLM 的 NSG 小鼠肺癌 CDX 模型,在肿瘤细胞移植 7 天后,小鼠随机分为Msln-CCR2b-CAR、Msln-CAR和PBS组,并进行2 次效应细胞的移植治疗。在肿瘤细胞移植35天后,小鼠活体成像提示 Msln-CAR 组小鼠有 60%肿瘤细胞完全清除,而Msln-CCR2b-CAR 组达到 100%的清除率。与 PBS 组相比,CAR T 细胞治疗组肿瘤重量显著降低 (P。肿瘤组织IHC分析表明CCR2b表达后使迁移浸润到肿瘤组织的CD3 T细胞数提高了2倍。
另外,对小鼠的心、肝、脾、肺、肾等进行病理学检测,未观察到明显的器质性病变。上述结果证实了新型Msln-CCR2b-CAR具有肿瘤全部清除能力与其较高的肿瘤组织归巢活性有关,显示出进一步临床转化和开发的潜力。
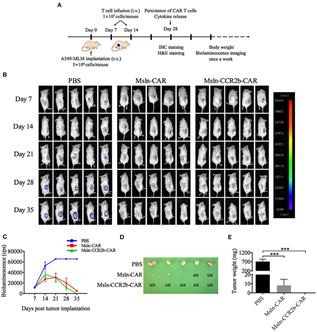
图2. NSG小鼠肺癌CDX模型中,CCR2b增强了Msln-CAR T细胞抗肿瘤作用
近几年来,朱焕章团队在基因编辑治疗的临床前研究方面取得一些进展。2020年利用CRISPR-Cas9文库大规模基因敲除技术首次筛选到HIV-1潜伏相关的基因PEBP1(EMBO Rep, 2020, e49305)。对于血液瘤及实体瘤的肿瘤免疫疗法也进行了研究,构建了靶向CD19、间皮素及EGFR的CAR T细胞,结合免疫检查点、趋化因子受体等从多个角度在人源化小鼠中增强了CAR T细胞的抗肿瘤功能。复旦大学生命科学学院博士王亚楠为论文第一作者,朱焕章教授为论文通讯作者。相关研究得到了国家传染病重大专项课题、 国家自然基金NSFC-NIH合作课题和国家自然基金面上课题资助。
论文链接:
https://www.frontiersin.org/articles/10.3389/fimmu.2021.628906/full?&utm_source=Email_to_authors_&utm_medium=Email&utm_content=T1_11.5e1_author&utm_campaign=Email_publication&field=&journalName=Frontiers_in_Immunology&id=628906
*本文转自腾讯网